Strain Name: /Gpt
Strain Type: Knock out
Strain No.: T001475
Strain Background: NOD/ShiLtJGpt
Strain Description
NCG (NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)는 중증 면역결핍 마우스 종으로, NOD/ShiltJGpt 마우스에서 Prkdc (Protein kinase, DNA activated, catalytic polypeptide) 유전자와 Il2rg (Common gamma chain receptor) 유전자를 유전자 편집 기술로 녹아웃(knockout)하여 개발한 것입니다. NOD/ShiltJGpt 마우스는 유전적으로 보체계(Complement system)와 대식세포가 결핍되는 등 선천적 면역결핍이 있습니다. 이 마우스는 사람의 CD47에 대한 SIRPa의 친화력이 매우 크기 때문에, 다른 마우스에 비해 NOD/ShiltJGpt 마우스가 사람의 종양이나 세포와 같은 사람 이식편의 정착에 더 적합합니다. Prkdc 유전자의 기능은 V(D)J 재조합 및 T세포와 B세포의 성숙을 불가능하게 하는 것입니다. IL2RG은 여러 인터루킨 사이토카인 수용체가 공유하는 구성단위로, IL2RG를 불활성화하면 6개의 사이토카인 신호전달 채널이 소실되어 NK세포 결함이 유발됩니다. 이러한 측면에서 볼 때, 면역이 완전히 결핍된 마우스 모델인 NCG는 세포 유래 이종이식(CDX), 환자 유래 이종이식(PDX), 그리고 사람 말초혈액단핵세포(PBMC)와 사람 조혈모세포(CD34+ HSC)를 이식하는 면역 재구성에 가장 적합합니다. 또한 NCG 마우스는 수명이 길기 때문에(89주 이상) 장기적 이식과 약력학적(PD) 평가에도 적합합니다.
Applications
사람의 면역계를 가진 마우스 모델(예. 인간화 BLT 마우스, 인간화 PBMC 마우스, 인간화 CD34+ 마우스 외 기타)
사람 세포주 유래 이종이식(CDX), 환자 유래 이종이식(PDX)
유효성 평가(Small molecular/maromolecular drugs, 병용요법)
사람 종양 모델
줄기세포 연구
Validation data
1. NCG의 말초혈액 면역세포의 종류별 통계분석
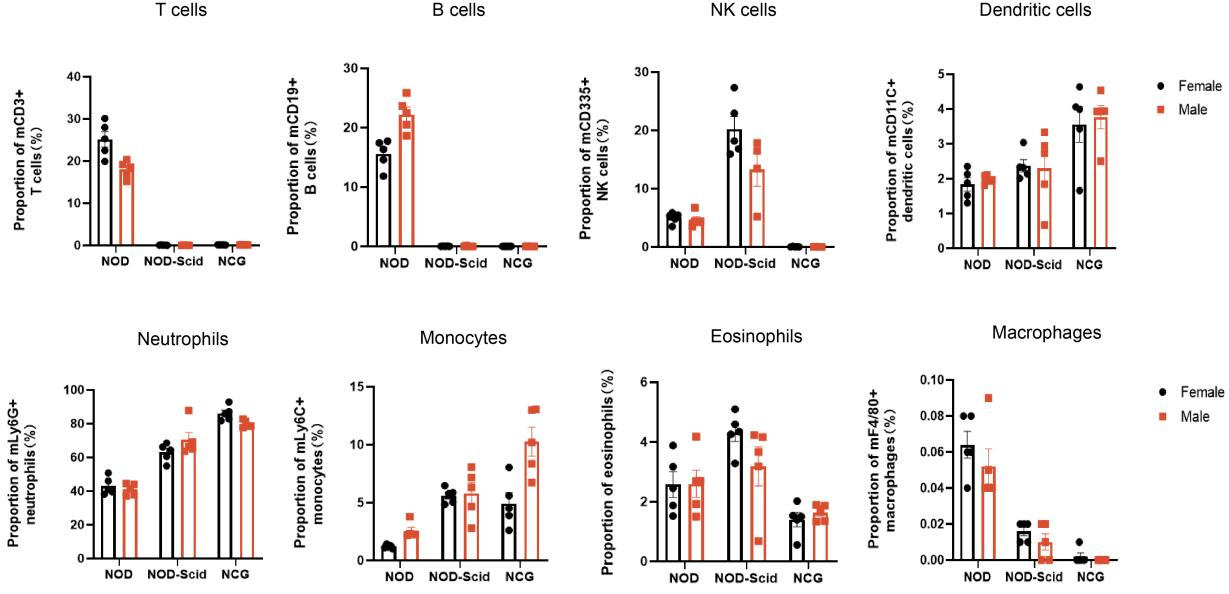
Figure 1 NOD, NOD-Scid and NCG mice statistical plot of the percentage of peripheral blood immune cell fractions (n=5)
7주령 NOD, NOD-SCID, NCG 마우스의 말초혈액을 수집하여 유세포분석을 통해 각 면역세포 분획의 비율을 확인하였습니다. 그 결과, NOD-SCID 마우스는 NOD 마우스에 비해 T세포와 B세포가 거의 없는 대신 보상적으로 NK세포의 비율이 증가되어 있었고, 수지상세포, 중성구, 단핵구, 호산구의 비율 또한 증가된 반면 대식세포 비율은 감소되어 있었습니다. NCG 마우스는 NOD 마우스에 비해 T세포, B세포, NK세포, 대식세포가 거의 없었으며, NOD-SCID 마우스보다도 면역결핍이 더욱 완전하였습니다.
2. NCG의 비장 면역세포의 종류별 통계분석
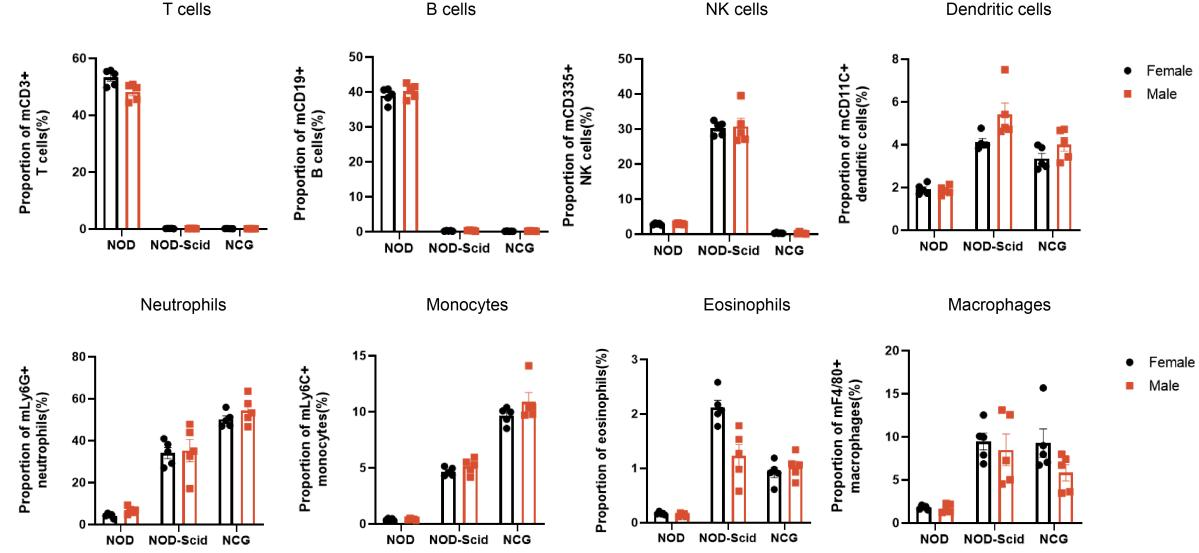
Figure 2. NOD, NOD-Scid and NCG mice statistical plot of the percentage of splenic immune cell fractions(n=5)
7주령 NOD, NOD-SCID, NCG 마우스의 비장을 수집하여 유세포분석을 통해 각 면역세포 분획의 비율을 확인하였습니다. 그 결과, NOD-SCID 마우스는 NOD 마우스에 비해 T세포와 B세포가 거의 없는 대신 보상적으로 NK세포의 비율이 증가되어 있었고, 수지상세포, 중성구, 단핵구, 호산구, 대식세포 비율도 증가되어 있었습니다. NCG 마우스는 NOD 마우스에 비해 T세포, B세포, NK세포가 거의 없었으며, 면역결핍의 정도가 더욱 심했습니다.
3. NCG의 골수 면역세포의 종류별 통계분석
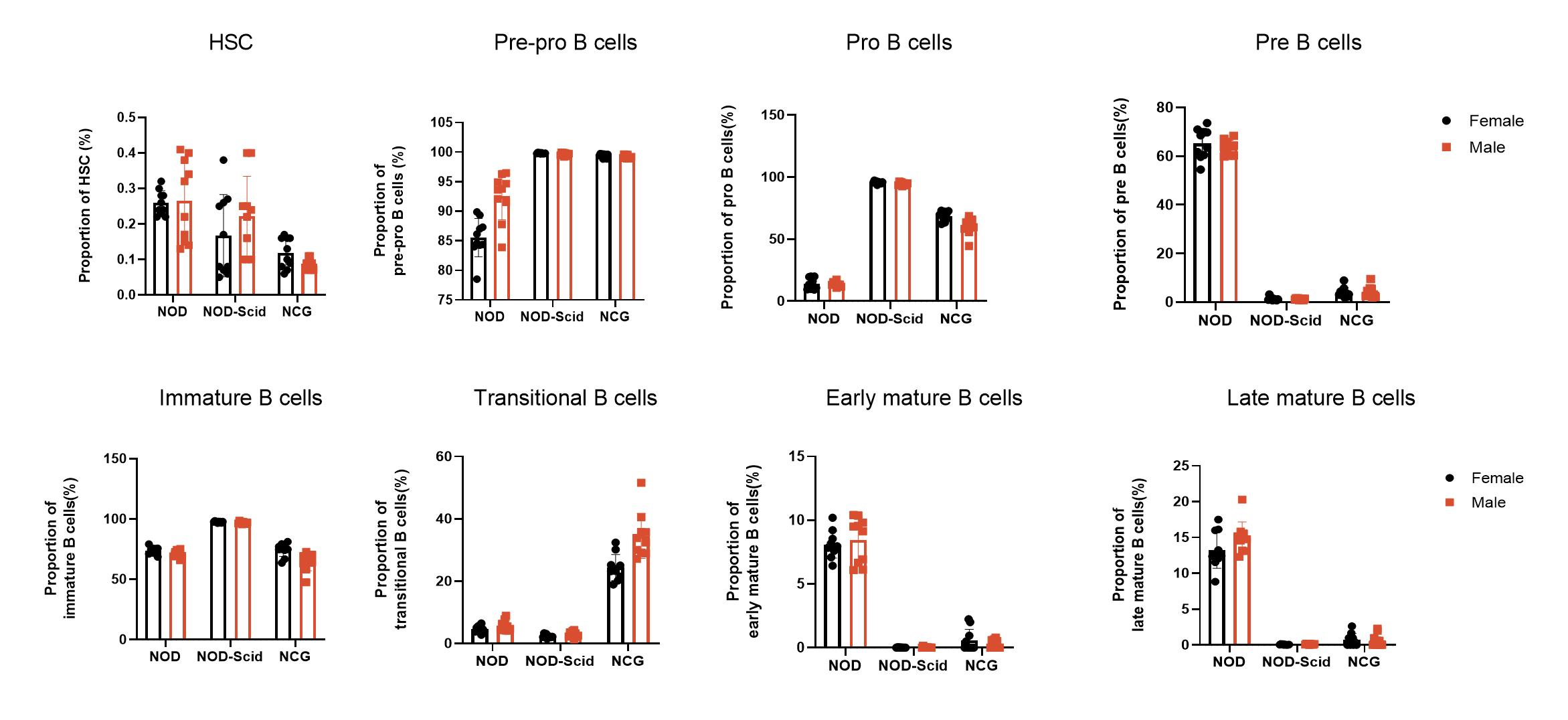
Figure 3 NOD, NOD-Scid and NCG mice statistical plot of the percentage of bone marrow immune cell fractions (n=5)
7주령 NOD, NOD-SCID, NCG 마우스의 골수를 수집하여 유세포분석을 통해 B세포 생성 동안의 각 세포 분획의 비율을 확인하였습니다(조혈모세포, Pre-pro-B, Pro-B, Pre-B, 미성숙 B, 이행기 B, 초기 성숙 B, 후기 성숙 B세포). 그 결과, NOD-SCID 마우스와 NCG 마우스의 골수에서는 NOD 마우스에 비해 Pre-pro B세포와 Pro B세포가 증가되어 있었으나 Pre-B세포와 초기/후기 성숙 B세포는 감소되어 있었습니다. 또한 NCG 마우스의 골수에서는 NOD 마우스 및 NOD-SCID 마우스에 비해 이행기 B세포가 유의하게 증가되어 있었습니다.
4. NCG의 비장, 흉선, 림프절의 H&E 염색
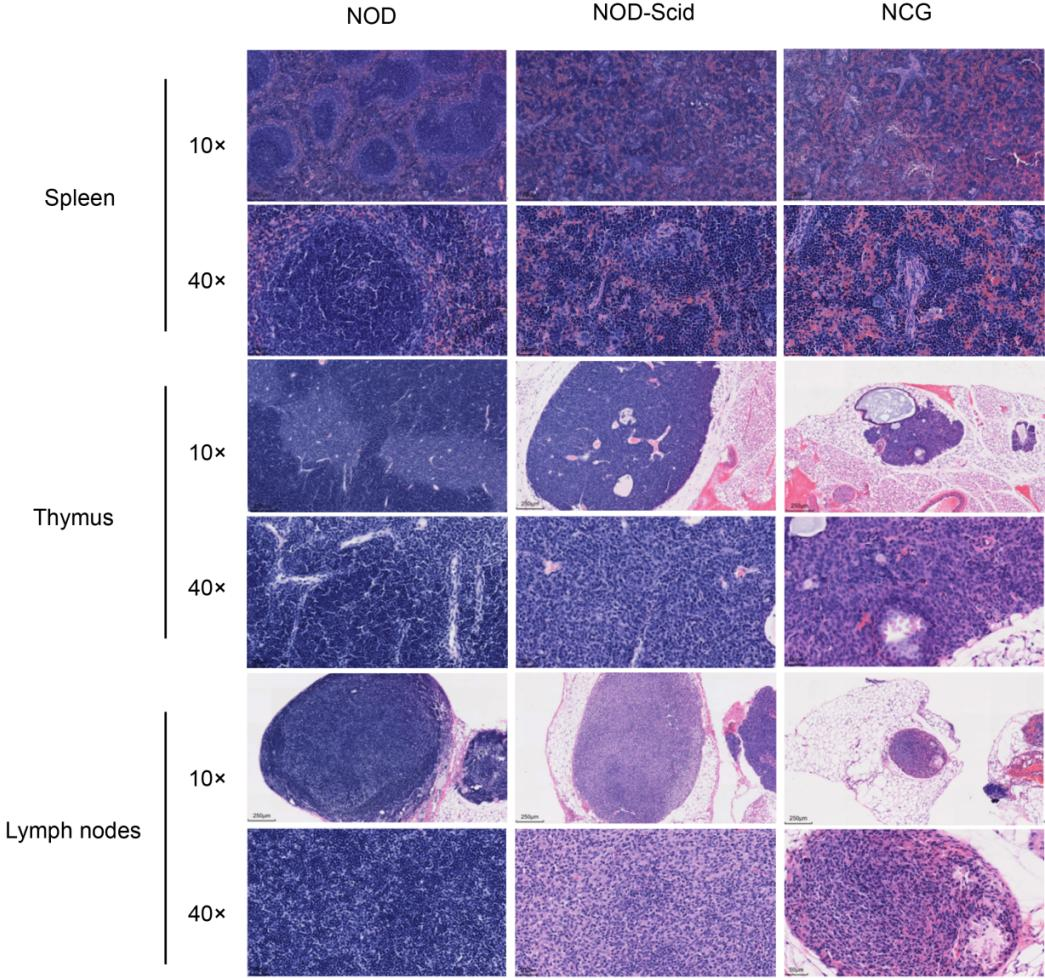
Figure 4. NOD, NOD-Scid and NCG mice H&E staining of spleen, thymus and lymph nodes
7주령 NOD, NOD-SCID, NCG 마우스의 비장, 흉선, 림프절을 수집하여 4% PFA로 고정하고 파라핀 포매하여 박절한 후 H&E 염색하여 이들 기관 구조에 이상이 있는지 조사하였습니다. 그 결과, NOD 마우스의 비장은 내부 구조가 온전하였으며 비후도 관찰되지 않았습니다. 비장의 굴은 팽창이 없었고, 비장 혈관 크기도 비정상적 변형이 없었으며, 적색 수질과 백색 수질의 비율도 거의 정상이었습니다. 흉선은 온전하였고, 피질과 수질도 정상이었으며, 수질에서 흉선 혈관이 뚜렷하였고, 출혈이나 위축과 같은 병리적 변화도 없었습니다. 림프절의 피질과 수질의 비율은 정상이었으며, 림프구가 감소하거나 괴사하지 않았습니다. 반면에 NOD-SCID 마우스와 NCG 마우스는 비장과 림프절의 크기가 감소되어 있었고 림프구의 수도 감소되어 있었습니다. 흉선의 피질과 수질이 명확하게 구분되지 않았고, 흉선이 위축되어 있었으며 피질과 수질 영역의 림프구가 유의하게 감소되어 있었습니다. 림프절도 피질과 수질이 명확하게 구분되지 않았고, 피질이 위축되어 있었으며, 피질과 수질 영역의 림프구가 유의하게 감소되어 있었습니다. H&E 염색 결과는 육안 관찰 결과 및 유세포분석 결과와 일치하였습니다.
또한 7주령 NOD, NOD-SCID, NCG 마우스의 심장, 간, 폐, 신장, 대장, 고환(수컷)도 수집하여 H&E 염색을 실시하였습니다. 그 결과, 모든 종류의 마우스에서 기관 조직 구조가 정상이었습니다.
5. NCG의 기관 지표 및 림프절 수
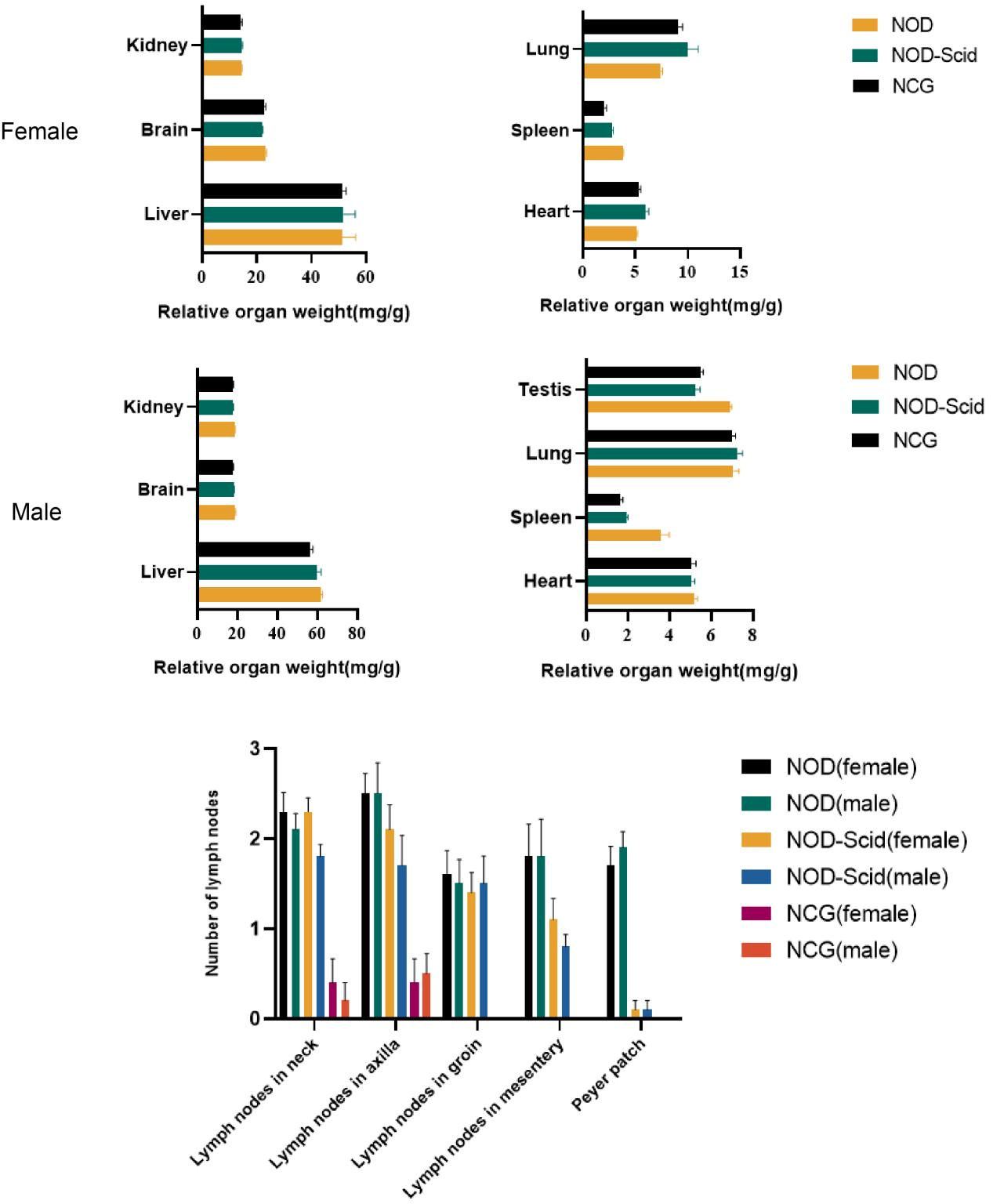
Figure 5. NOD, NOD-Scid and NCG mice comparison of organ indices and number of lymph nodes (n=10)
7주령 NOD, NOD-SCID, NCG 마우스의 심장, 간, 비장, 폐, 신장, 뇌, 고환(수컷)을 수집하여 기관 무게를 측정하고 기관 지표를 계산하였습니다. 그 결과, NOD-SCID 마우스와 NCG 마우스의 비장 지표가 NOD 마우스에 비해 유의하게 감소하였는데, NCG 마우스의 감소가 더욱 현저하였습니다. 나머지 기관 지표는 유의한 차이가 없었습니다.
또한, 경부림프절, 액와림프절, 서혜림프절, 장간막림프절, 페이어패치(Peyer's patch)의 수를 계수한 결과, NOD-SCID 마우스와 NCG 마우스의 림프절 수가 NOD 마우스에 비해 유의하게 감소하였으며 특히 NCG 마우스는 서혜림프절, 장간막림프절, 페이어패치가 전무한 것으로 나타났습니다.
6. NCG의 성장 곡선
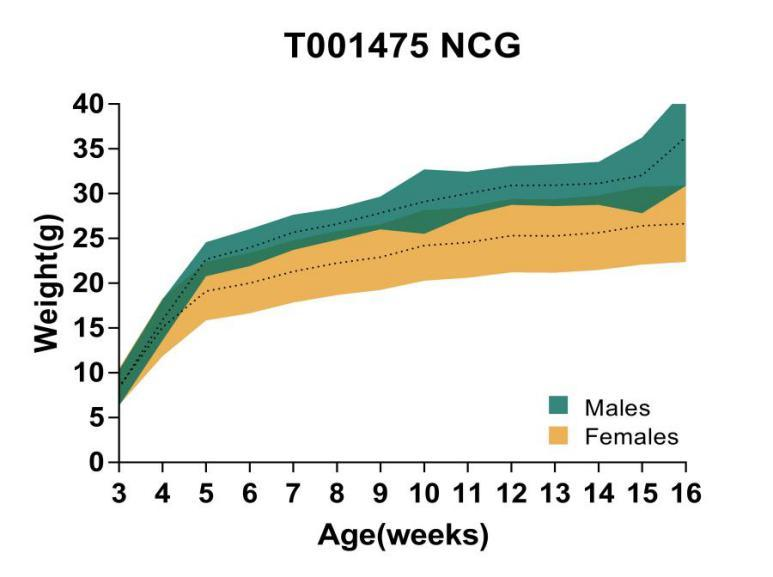
Figure 6. Growth curve of NCG mice
16주령 NCG 마우스의 체중을 분석하였습니다. 분석 결과, NCG 마우스 수컷의 체중이 암컷보다 대체로 크게 나타났습니다.
7. 일반혈액분석
NOD | NOD-Scid | NCG | ||||
Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | |
WBC(K/uL) | 2.37±0.77 | 2.45±1.16 | 1.37±0.46 | 1.19±0.28 | 0.88±0.21 | 1.15±0.26 |
Lym(K/uL) | 1.35±0.38 | 1.24±0.70 | 0.26±0.08 | 0.30±0.06 | 0.12±0.04 | 0.29±0.15 |
Mon(K/uL) | 0.227±0.15 | 0.28±0.15 | 0.20±0.07 | 0.10±0.06 | 0.04±0.02 | 0.05±0.03 |
Neu (K/uL) | 0.67±0.29 | 0.81±0.35 | 0.79±0.32 | 0.72±0.20 | 0.66±0.19 | 0.76±0.13 |
Eos (K/uL) | 0.12±0.06 | 0.12±0.02 | 0.10±0.05 | 0.07±0.02 | 0.07±0.02 | 0.05±0.01 |
Bas (K/uL) | 0.01±0.01 | 0.01±0.01 | 0.01±0.01 | 0.003±0.006 | 0.00±0.00 | 0.00±0.00 |
RBC(M/uL) | 7.68±0.22 | 8.00±0.35 | 7.46±0.40 | 8.39±0.84 | 7.98±0.68 | 7.87±0.54 |
HGB(g/L) | 144.60±4.83 | 149.00±4.64 | 134.60±6.27 | 147.80±11.39 | 143.00±11.90 | 140.20±9.68 |
HCT(%) | 39.88±1.15 | 42.04±1.85 | 38.82±2.34 | 43.64±4.13 | 41.24±3.63 | 40.82±3.29 |
MCV (fL) | 51.96±0.53 | 52.62±0.62 | 52.10±0.66 | 52.12±0.62 | 51.74±0.35 | 51.90±0.85 |
MCH (pg) | 18.76±0.31 | 18.60±0.40 | 18.00±0.16 | 17.62±0.43 | 17.88±0.15 | 17.76±0.30 |
MCHC(g/L) | 362.00±4.95 | 354.20±5.98 | 346.40±6.07 | 338.80±8.64 | 346.60±3.78 | 343.20±5.54 |
RDW_CV(%) | 13.12±0.16 | 13.46±0.49 | 13.70±0.70 | 13.60±0.20 | 13.44±0.34 | 13.92±0.18 |
RDW_SD(fL) | 42.84±1.18 | 42.68±0.75 | 43.20±0.96 | 43.20±1.13 | 43.02±1.00 | 42.52±1.06 |
PLT(K/uL) | 1289.6±89.45 | 1482.60±175.24 | 1375.40±167.61 | 1533.60±236.50 | 1226.20±171.79 | 1665.60±45.92 |
MPV (fL) | 4.84±0.17 | 5.06±0.23 | 4.86±0.09 | 4.74±0.11 | 4.74±0.20 | 4.78±0.11 |
PDW(fL) | 10.62±0.57 | 11.42±0.86 | 10.64±0.36 | 10.62±0.43 | 10.54±0.75 | 10.64±0.22 |
PCT(%) | 0.62±0.05 | 0.74±0.07 | 0.66±0.09 | 0.72±0.12 | 0.58±0.06 | 0.79±0.03 |
P_LCR(%) | 19.82±1.73 | 22.62±3.13 | 20.85±1.18 | 19.86±1.72 | 18.77±2.63 | 19.33±1.48 |
P_LCC(K/uL) | 255.0±23.24 | 331.80±32.77 | 286.60±42.51 | 304.40±60.66 | 226.60±17.04 | 321.40±27.20 |
NRBC(K/uL) | 5.28±11.50 | 10.77±14.56 | 0.30±0.54 | 0.36±0.72 | 0.03±0.01 | 0.04±0.01 |
ALY(K/uL) | 0.03±0.008 | 0.03±0.02 | 0.001±0.002 | 0.003±0.005 | 0.00±0.00 | 0.01±0.01 |
LIC(K/uL) | 0.01±0.006 | 0.01±0.002 | 0.01±0.006 | 0.01±0.006 | 0.01±0.003 | 0.01±0.004 |
표 1. 7주령 NOD, NOD-SCID, NCG 마우스의 전혈구수 분석
8. 혈액화학분석
NOD | NOD-Scid | NCG | ||||
Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | Female(n=5) (Mean±SEM) | Male(n=5) (Mean±SEM) | |
ALT(IU/L) | 21.72±5.47 | 34.48±4.60 | 24.04±7.87 | 62.56±40.44 | 51.44±67.41 | 41.40±12.92 |
AST(IU/L) | 131.64±41.36 | 160.28±38.45 | 130.64±13.96 | 191.12±67.60 | 168.24±100.82 | 142.00±36.95 |
CK(mg/L) | 296.40±222.91 | 572.80±346.63 | 198.40±25.67 | 337.20±165.49 | 194.00±20.35 | 196.40±40.65 |
ALB(g/L) | 42.16±2.00 | 40.28±2.36 | 42.68±3.20 | 39.64±2.77 | 42.36±2.03 | 40.44±2.71 |
TBIL(umol/L) | 1.69±0.67 | 2.38±0.43 | 1.84±0.21 | 2.33±0.51 | 1.38±0.40 | 1.95±0.71 |
BUN(mmol/L) | 7.28±0.92 | 8.97±1.00 | 8.11±1.02 | 10.55±1.27 | 8.20±0.70 | 8.46±1.02 |
CREA(umol/L) | 7.40±3.72 | 6.36±2.45 | 5.96±1.04 | 8.12±1.15 | 6.40±1.92 | 6.76±2.30 |
CHO(mmol/L) | 2.68±0.17 | 3.88±0.44 | 2.47±0.31 | 3.06±0.47 | 2.32±0.30 | 3.58±0.31 |
TG(mmol/L) | 0.62±0.23 | 1.35±0.62 | 0.70±0.32 | 1.65±0.91 | 0.45±0.17 | 1.52±0.46 |
LDH(IU/L) | 2738.80±527.71 | 2986.40±579.96 | 3297.20±625.20 | 3470.00±554.64 | 3258.00±193.99 | 3557.2±559.94 |
LDL(mmol/L) | 0.29±0.05 | 0.26±0.01 | 0.25±0.09 | 0.08±0.04 | 0.30±0.08 | 0.31±0.07 |
GLU(mmol/L) | 1.52±0.74 | 1.44±0.87 | 1.02±1.06 | 3.36±2.04 | 0.64±0.67 | 2.26±1.78 |
HDL(mmol/L) | 2.06±0.14 | 3.09±0.34 | 1.86±0.24 | 2.42±0.37 | 1.71±0.23 | 2.78±0.22 |
TP(g/L) | 59.88±4.68 | 62.96±4.02 | 58.56±4.37 | 61.20±4.84 | 57.96±1.97 | 61.52±4.05 |
AKP(IU/L) | 213.20±10.35 | 182.40±10.71 | 184.80±21.48 | 160.00±10.49 | 205.60±7.54 | 150.40±14.99 |
표 2. 7주령 NOD, NOD-SCID, NCG 마우스의 혈액화학분석
9. NCG의 종양원성시험
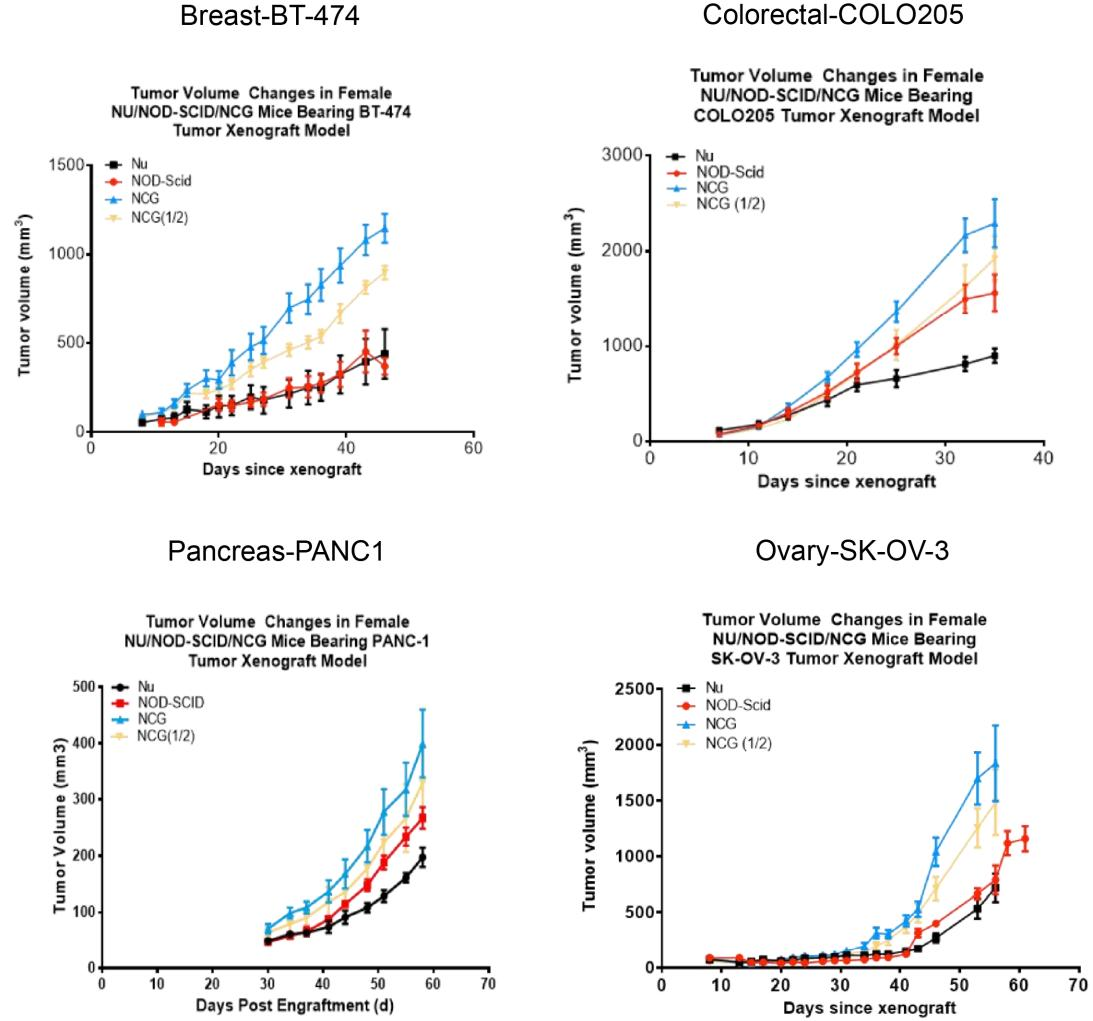
Figure 7. NCG mice tumorigenicity test
급속 성장기인 6-8주령의 Nu/NOD-SCID/NCG 마우스에 사람 유방암 세포주인 BT-474, 사람 대장암 세포주인 COLO205, 사람 췌장암 세포주인 PANC1, 사람 난소암 세포주인 SK-OV-3를 각각 피하 접종한 결과, 시간에 따라 종양 크기가 점증 곡선 형태로 증가하였습니다. (종양 용적은 평균±표준오차로 표시함)
10. NCG의 유효성 시험
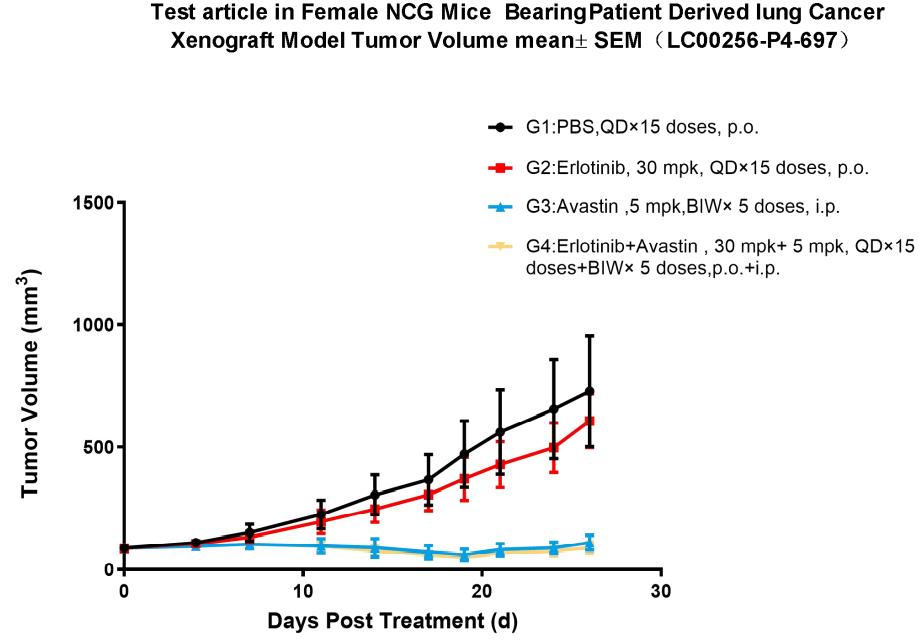
Figure 8. Pharmacodynamic evaluation of erlotinib in NCG mice subcutaneously transplanted with PDX model of lung cancer
그림 8. 폐암 PDX 모델을 피하 이식한 NCG 마우스에서 엘로티닙(erlotinib)의 약력학적(PD) 평가
폐암 PDX 모델을 NCG 마우스에 피하 이식하여 엘로티닙의 항암 효과를 평가하고자 하였습니다. 그 결과, 모델 대조군에 비해 엘로티닙 투여군에서 종양 성장이 유의하게 억제되었습니다. 더불어, 아바스틴(avastin)을 병용하면 엘로티닙 단독투여군보다 종양 성장이 유의하게 억제되었습니다. (종양 용적은 평균±표준오차로 표시함)
발표된 문헌
Hu B, Yu M, Ma X, et al. Interferon-a potentiates anti-PD-1 efficacy by remodeling glucose metabolism in the hepatocellular carcinoma microenvironment. Cancer discovery. Apr 12 2022;doi:10.1158/2159-8290.Cd-21-1022. (IF:39.397)
Ma W, Yang Y, Zhu J, et al. Biomimetic Nanoerythrosome‐Coated Aptamer‐DNA Tetrahedron/Maytansine Conjugates: pH‐Responsive and Targeted Cytotoxicity for HER2‐positive Breast Cancer. Advanced Materials.2109609. (IF:30.849)
Song H, Liu D, Wang L, et al. Methyltransferase like 7B is a potential therapeutic target for reversing EGFR-TKIs resistance in lung adenocarcinoma. Molecular cancer. Feb 10 2022;21(1):43. (IF:41.444)
Zhang L, Zhu Z, Yan H, et al. Creatine promotes cancer metastasis through activation of Smad2/3. Cell metabolism. 2021;33(6):1111-1123. e4. (IF:22.4)
Liu C, Zou W, Nie D, et al. Loss of PRMT7 reprograms glycine metabolism to selectively eradicate leukemia stem cells in CML. Cell Metab. Apr 26 2022. (IF:22.4)
Zhang X-N, Yang K-D, Chen C, et al. Pericytes augment glioblastoma cell resistance to temozolomide through CCL5-CCR5 paracrine signaling. Cell Research. 2021:1-16. (IF:25.617)
Dai Z, Mu W, Zhao Y, et al. T cells expressing CD5/CD7 bispecific chimeric antigen receptors with fully human heavy-chain-only domains mitigate tumor antigen escape. Signal transduction and targeted therapy. Mar 25 2022;7(1):85. (IF:18.187)
Dai Z, Liu H, Liao J, et al. N7-Methylguanosine tRNA modification enhances oncogenic mRNA translation and promotes intrahepatic cholangiocarcinoma progression. Molecular Cell. 2021. (IF:17.97)
Hao M, Hou S, Li W, et al. Combination of metabolic intervention and T cell therapy enhances solid tumor immunotherapy. Science Translational Medicine. 2020;12(571). (IF:17.956)
Liu Y, Liu G, Wang J, et al. Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors. Science Translational Medicine. 2021;13(586). (IF:17.956)
Yan H, Wang Z, Sun Y, Hu L, Bu P. Cytoplasmic NEAT1 Suppresses AML Stem Cell Self‐Renewal and Leukemogenesis through Inactivation of Wnt Signaling. Advanced Science. 2021;8(22):2100914. (IF:17.521)
Luo Q, Wu X, Chang W, et al. ARID1A prevents squamous cell carcinoma initiation and chemoresistance by antagonizing pRb/E2F1/c-Myc-mediated cancer stemness. Cell Death & Differentiation. 2020;27(6):1981-1997. (IF:12.067)
Wu M, Zhang X, Zhang W, et al. Cancer stem cell regulated phenotypic plasticity protects metastasized cancer cells from ferroptosis. Nature communications. Mar 16 2022;13(1):1371. (IF:14.919)
Liu H, Bai L, Huang L, et al. Bispecific antibody targeting TROP2xCD3 suppresses tumor growth of triple negative breast cancer. Journal for ImmunoTherapy of Cancer. 2021;9(10):e003468. (IF:12.469)

